Nupo – syntyjään sarveton -sarjan viimeisessä osassa perehdytään geenieditointiin ja selvitetään, kuinka sen avulla voidaan tuottaa nupoja eläimiä: mitä osataan jo ja mitä haasteita on.
Rodun muuttaminen nupoksi perinteisen jalostuksen keinoin on hidasta. Voimakas keskittyminen nupojen eläinten valintaan myös hidastaa edistymistä muissa ominaisuuksissa. Limousin on hyvä esimerkki rodusta, jossa nupo linja on perinnölliseltä tasoltaan selkeästi sarvellista heikompi. Tämän takia jalostajat suosivat edelleen sarvellisia eläimiä, vaikka syntymänupoudesta on monia etuja.
Ei ole siis ihme, että tällä hetkellä tutkitaan voisivatko uusimmat molekyyligenomiikan tekniikat mahdollistaa nupojen eläinten tuottamisen aiempaa helpommin ja nopeammin.
Geenisakset genomieditoinnissa
Ymmärryksemme DNA:sta, geeneistä, genomin eli perimän sisäisestä kommunikaatiosta sekä geenien säätelystä on kasvanut eksponentiaalisesti viimeisten vuosikymmenten aikana, vaikka on vielä paljon sellaistakin, mitä emme tiedä. Geeniteknologia on kehittynyt käsi kädessä biologisen ymmärryksen kasvun kanssa. Tarve ymmärtää yksittäisten geenien toimintaa esimerkiksi syövän molekyylimekanismeja tutkittaessa on kannustanut tutkijoita kehittämään yhä parempia geenitekniikoita.
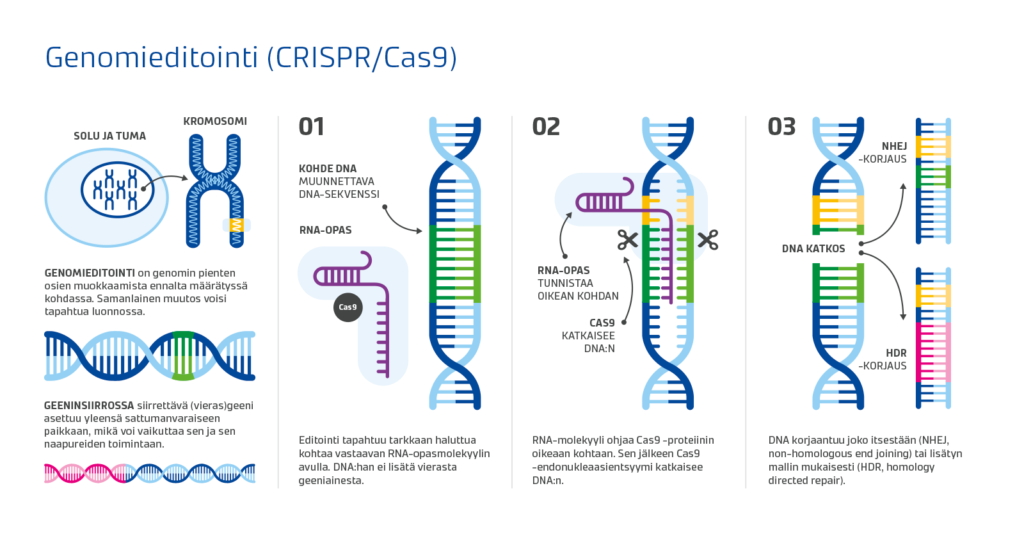
Varhaisimmat geenieditoinnin tekniikat olivat hapuilevia yrityksiä verrattuna uusimpiin genomin muokkausmenetelmiin eli niin sanottuihin geenisaksiin. Näitä ovat esimerkiksi TALEN (transcription activator-li- ke effector nuclease) ja CRISPR-Cas9 (clustered regularly interspaced palindromic repeats-CRISPR-associated proteins). Näistä CRISPR-Cas9 on otettu laajasti käyttöön, koska se on menetelmänä halpa, suhteellisen helppo ja tehokas.
CRISPR-Cas9 -menetelmässä RNA-opasmolekyylin avulla ohjataan Cas9 endonukleaasientsyymi genomissa haluttuun kohtaan. Entsyymi katkaisee genomin täsmälleen halutusta kohdasta. Katkaistu kohta voidaan korjata joko ilman mallia tai mallin avulla. Mikäli solu korjaa katkaistun kohdan ilman mallia, siihen tulee helposti virheitä. Tätä käytetään hyväksi tutkittaessa yksittäisen geenin vaikutuksia: mitä tapahtuu, kun geeni ei toimi korjausvirheen takia laisinkaan (knock-out).
Mikäli solulla on käytössään malli, joka ohjaa solua korjaamaan katkaisukohdan halutunlaiseksi, korjaaminen tapahtuu yleensä virheettömästi. Juuri tätä ominaisuutta käytetään hyväksi, kun halutaan tuottaa nupo eläin (knock-in). Solulle vain annetaan malli, jonka geneettinen koodi on halutunlainen, tässä tapauksessa kromosomin 1 POLLED-alueen nupo Celtic-muoto.
Kaikki alkaa solumaljoilta
Yhdysvaltalainen ja saksalainen tutkimusryhmä kasvattivat tahoillaan lypsyrotuisten sonnien sidekudossoluja maljoilla. Näiden solulinjojen POLLED-alueen sarvellinen Friesian-muoto leikattiin irti ja korvattiin nupolla Celtic-muodolla käyttäen geenisaksia. Yhdysvaltalainen ryhmä käytti geenieditointiin TALEN-tekniikkaa. Vuonna 2020 julkaistun saksalaistutkimuksen tekniikkana käytettiin jo uudempaa CRISPR-Cas12a -tekniikkaa.
Geenisaksien toiminta ei ole täydellistä, joten käsitellyistä soluista on valittava ne, joissa geenisakset ovat toimineet ja nupo Celtic -muoto on korvannut sarvellisen muodon. Onnistuneesti geenieditoidun solun tumalla korvataan munasolun tuma (SCNT, somatic cell nuclear transfer). Muokatusta munasolusta kehittynyt alkio siirretään vastaanottajalehmään kasvamaan.
Molemmissa tutkimuksissa alkioita tuotettiin useampia. Osa tiineyksistä päättyi kesken, mutta osa onnistui. Syntyneet vasikat olivat sekä fyysisen tarkastelun että genomin analysoinnin perusteella nupoja.
Menetelmän haasteet
Kummassakaan tutkimuksessa ei havaittu viitteitä, että geenisakset olisivat toimineet muualla kuin kohdealueella. Yhdysvaltalaistutkimuksessa syntyneet kaksi sonnivasikkaa olivat fyysisesti terveitä, eivätkä ne poikenneet perusteellisten tutkimusten mukaan tavallisista vasikoista.
Kuitenkin tutkimuksissa huomattiin myöhemmin, että toinen geenieditoitu sonni ei ollut virheettömästi homotsygoottinupo. Vain sonnin toinen Celtic-alleeli oli normaali. Toisen Celtic-alleelin perään sonni oli saanut TALEN-geenisaksien käytön myötä ylimääräistä DNA-sekvenssiä. Sieltä löytyi sekä geenisaksien kuljettamiseen käytettyä bakteeri-DNA:ta että editoinnissa mallina käytetty Celtic-sekvenssipala.
Löydöksen myötä sonni määritettiin geenimuunnelluksi. Sonni sai tutkimuskarjassa vielä 6 nupoa jälkeläistä, joista osa peri isältään bakteeri-DNA:ta sisältävän Celtic-alleelin.
Saksalaistutkimuksessa vastaavia yllätyksiä ei löytynyt. Kuitenkin vasikka kuoli pian syntymänsä jälkeen. Se oli normaalia suurikokoisempi ja useat sen elimet olivat vajaasti kehittyneitä. Muokatuille alkioille on tyypillistä, että sekä alkiokuolemat että kehityshäiriöt ovat normaaleja tiineyksiä yleisempiä.
Vaikka geeniteknologiset menetelmät ovat huomattavasti jo kehittyneet, kehitettävää on edelleen. Yhtä lailla lainsäätäjien on päätettävä, ovatko geenisakset osa tulevaisuuden eläinjalostusta vai eivät.
Teksti: Anna-Maria Leino, erikoistutkija, Luke
Video geenisaksien toiminnasta:
Jutun voit lukea myös joulukuun Nauta-lehdestä 5/2021!
Juttusarjan edelliset osat:
- Nupo – Syntyjään sarveton, osa 1
- Nupo – Syntyjään sarveton, osa 2: Nupouden periytyminen on vielä osaksi mysteeri
- Nupo – Syntyjään sarveton, osa 3: Nupous selviää genomitestillä
- Nupo – Syntyjään sarveton, osa 4: Nahkasarvet ovat monimuotoiset
Lähteet:
- Young, A. E., Mansour, T. A., McNabb, B. R., Owen, J. R., Trott, J. F., Brown, T. C., and A. L. Van Eenennaam. 2020. Genomic and phenotypic analyses of six offspring of a genome-edited hornless bull. Nature Biotechnology 38: 225-232.
- Schuster, F., Aldag, P., Frenzel, A., Hadeler, K.-G., Lucas-Hahn, A., Niemann, H., and B. Petersen. CRISPR/Cas12a mediated knock-in of the Polled Celtic variant to produce a polled genotype in dairy cattle. Nature Research 10: 13570.
- F., Carlson et al. 2016. Production of hornless dairy cattle from genome-edited cell lines. Nature Biotechnology 34: 479–481.
Sananen lainsäädännöstä
Suomessa geenitekniikan menetelmien käyttöä ohjaa geenitekniikkalaki, joka tuli voimaan 1995. Valvontaviranomaisena maa- ja metsätalousalalla toimii Suomessa Ruokavirasto.
EU:n tuomioistuin määritteli geenieditoinnin geenimuunteluksi eli GMO-lainsäädännön alle vuonna 2018, vaikka geenieditoinnissa ei lisätä vierasta DNA:ta genomiin. GMO-säädökset tekevät geenieditoitujen tuotteiden lupaprosessista niin kalliin, että tekniikan käyttöön ei käytännössä ole varaa.
EU on ottanut geenieditoinnin tarkastelun uudelleen käsittelyyn, mutta lainsäädännön muuttuminen voi viedä vuosia. Geenitekniikan menetelmät kehittyvät nopeasti. Monissa muissa maissa, kuten USA:ssa ja Kiinassa lainsäädäntö on huomattavasti sallivampi geenieditoinnille. Onkin aiheellista kysyä, onko vaarana että EU-maat jäävät kehityksessä jälkeen?
Teksti: Sonja Närkki, Fabalab

